La dieta cetogénica es un enfoque de tratamiento de terapia nutricional para apoyar la terapia convencional contra el cáncer. Lo especial en esta terapia nutricional es que actúa específicamente sobre las peculiaridades metabólicas de las células cancerosas y las aprovecha las „debilidades“ de estos cambios metabólicos.
Las células cancerosas absorben en comparación con los tejidos circundantes enormes cantidades de azúcar en forma de glucosa (dextrosa) con el fin de cubrir el aumento de las necesidades de energía para su crecimiento y multiplicación. Pero mientras la mayoría de las células sanas „queman“ los nutrientes, muchas células cancerosas, particularmente las células agresivas, metastásicas y resistentes a la terapia presentan una tasa inusualmente alta de fermentación del azúcar, incluso en presencia de oxígeno [note]Warburg, O. (1956): On the origin of cancer cells. Science 123 (3191): 309–314. [Link zum Artikel].[/note]. Estudios recientes han podido aclarar que la propia célula cancerosa se protege del estrés oxidativo mediante el cambio a esta forma alternativa de obtener energía [note]Aykin-Burns, N. et al. (2009): Increased levels of superoxide and H2O2 mediate the differential susceptibility of cancer cells versus normal cells to glucose deprivation. Biochem J 418 (1): 29–37. [Link zum Artikel].[/note] [note]Spitz et al. (2000): Glucose deprivation-induced oxidative stress in human tumor cells. A fundamental defect in metabolism? Ann N Y Acad Sci 899: 349–362. [Link zum Artikel].[/note]. Al mismo tiempo, sin embargo, esto también inhibe la eficacia de muchos agentes quimioterapéuticos y formas de radiación. Basándose en estos resultados, se ha desarrollado el concepto de privar a las células de este importante proveedor de energía por una reducción significativa en el suministro de azúcar a las células cancerosas y aumentar el estrés oxidativo en la célula tumoral [note]Allen, B. G. et al. (2013): Ketogenic diets enhance oxidative stress and radio-chemo-therapy responses in lung cancer xenografts. Clin Cancer Res 19 (14): 3905–3913. [Link zum Artikel].[/note] [note]Fath, M. A. et al. (2009): Mitochondrial electron transport chain blockers enhance 2-deoxy-D-glucose induced oxidative stress and cell killing in human colon carcinoma cells. Cancer Biol Ther 8 (13): 1228–1236. [Link zum Artikel].[/note] [note]Hadzic, T. et al. (2010): Paclitaxel combined with inhibitors of glucose and hydroperoxide metabolism enhances breast cancer cell killing via H2O2-mediated oxidative stress. Free Radic Biol Med 48 (8): 1024–1033. [Link zum Artikel].[/note].
→ Una nota importante al comienzo:
Los conceptos de la dieta cetogénica sólo sirven para apoyar una terapia propuesta por el oncólogo tratante. Mediante la selección de alimentos ricos en calorías y nutrientes deben contribuir a fortalecer la condición física del paciente y mejorar la compatibilidad y el éxito del tratamiento del método de terapia aplicado. A diferencia de muchas „dietas de cáncer“ dudosas y a menudo criticadas, la dieta de cáncer cetogénica NO pretende ser capaz de curar el cáncer en sí y hacer que sean innecesarias las terapias convencionales como la quimioterapia o la terapia de radiación.
¿Qué significa una dieta cetogénica?
Típico de una forma dieta cetogénica es un muy alto contenido en grasa y muy bajo contenido en hidratos de carbono. Expresado en números, esto significa que aproximadamente el 75-80% de la energía suministrada proviene de grasa, 15-20% de proteína y sólo alrededor de 5% proviene de carbohidratos.
 |
| Distribución de nutrientes de diferentes dietas |
|---|
El nombre „cetogénica“ significa literalmente „que forma cuerpos de cetona“, lo que es un efecto sustancial de esta dieta. Los cuerpos cetónicos como acetoacetato, ácido β-hidroxibutírico y acetona son derivados de la grasa, que antiguamente fue una fuente de energía vital para el cuerpo. En períodos de escasez de alimentos, el cuerpo comienza a usar sus reservas almacenadas en el tejido adiposo. Las grasas llegan al hígado, donde se transforman en cuerpos cetónicos y se liberan nuevamente en el torrente sanguíneo para abastecer en particular el cerebro. De esta manera, el hombre ha podido sobrevivir incluso bajo condiciones de inanición durante algún tiempo. Debido al alto contenido de carbohidratos que ofrece nuestra dieta moderna, las personas sanas hoy en día alcanzan este tipo de situación metabólica denominada como cetosis por lo general sólo durante el ayuno.
→ Cetosis través de la dieta cetogénica
Mediante una dieta cetogénica, sin embargo, también es posible alcanzar un metabolismo cetogénico sin renunciar a la comida. Debido a la ingesta muy baja en carbohidratos y azúcar, el nivel de azúcar en sangre no se incrementa y por lo tanto no se libera ninguna insulina adicional. Esta hormona es generalmente la que señaliza la necesidad de almacenar las grasas ingeridas en las células adiposas del cuerpo. Sin esta señal, sin embargo, el cuerpo se ve obligado a utilizar la grasa suministrada directamente y convertirla parcialmente en cuerpos cetónicos.
→ Clínicamente probado
El principio de conseguir mediante una dieta cetogénica un estado metabólico casi similar al ayuno, se ha venido comprobado clínicamente durante décadas en pacientes con epilepsia. Después de que los médicos a comienzios de la década de los años 20 reconocieron el efecto mitigador del ayuno sobre la frecuencia de los ataques, hasta la introducción de los primeros medicamentos para la epilepsia se estableció el uso de una nutrición con énfasis en los aceites y las proteínas como un método de terapia reconocido. Aún hoy en día, una dieta cetogénica representa el tratamiento de elección en pacientes con epilepsia que no responden a ninguno de los fármacos actuales.
También en otras enfermedades se discute ahora sobre un posible beneficio terapéutico de la dieta cetogénica: enfermedades neurodegenerativas como el Alzheimer, el Parkinson [note]Baranano, K. W.; Hartman, A. L. (2008): The ketogenic diet: uses in epilepsy and other neurologic illnesses. Curr Treat Options Neurol 10 (6): 410–419. [Link zum Artikel].[/note] y ALS [note]Zhao, Z. et al. (2006): A ketogenic diet as a potential novel therapeutic intervention in amyotrophic lateral sclerosis. BMC Neurosci 7: 29. [Link zum Artikel].[/note], trastornos neurológicos como el autismo [note]Evangeliou, A. et al. (2003): Application of a ketogenic diet in children with autistic behavior: pilot study. J Child Neurol 18 (2): 113–118. [Link zum Artikel].[/note] o trastornos metabólicos tales como el síndrome de ovario poliquístico [note]Mavropoulos, J. C. et al. (2005): The effects of a low-carbohydrate, ketogenic diet on the polycystic ovary syndrome: a pilot study. Nutr Metab (Lond) 2: 35. [Link zum Artikel].[/note] o la diabetes tipo 2 [note]Westman, E. C. et al. (2008): The effect of a low-carbohydrate, ketogenic diet versus a low-glycemic index diet on glycemic control in type 2 diabetes mellitus. Nutr Metab (Lond) 5: 36. [Link zum Artikel].[/note].
De la hipótesis al concepto de alimentación
Ya en 1924, el bioquímico y posterior premio Nobel alemán Otto Warburg reconoció la forma particular en que las células cancerosas obtienen energía. En sus estudios en células sanas y anormales, él observó concentraciones inusualmente altas de ácido láctico en las células cancerosas resistentes – incluso si exponía las células al oxígeno [note]Warburg, Otto (1924): Über den Stoffwechsel der Carcinomzelle. Naturwissenschaften 12 (50): 1131–1137. [Link zum Artikel].[/note] . Esto era inusual porque la mayoría de las células sanas sólo lo producen con una falta de oxígeno, es decir, en condiciones anaerobias.
El ácido láctico se forma durante la fermentación del azúcar (glucólisis anaeróbica). Esta forma de producción de energía es más bien ineficaz, desde el punto de vista energético, pero, sin embargo, no requiere oxígeno. Para la mayoría de las células, este camino representa una especie de „solución de emergencia“, para que en caso de una falta temporal de oxígeno – como puede ocurrir, por ejemplo, durante el entrenamiento intensivo en las células del músculo – puedan continuar produciendo energía. Una vez que vuelve a estar disponible el oxígeno, las células sanas vuelven a su forma habitual de obtención de energía a través de sus propias „plantas generadoras de energía“, las mitocondrias, la espalda.
Warburg supuso que las mitocondrias de las células de cáncer debían estas trastornadas y planteó la hipótesis de que esa era la causa del cáncer. Un indicio importante de esto era para él también la observación de que el agresivo desarrollo de las células cancerosas mostraba el metabolismo energético alterado, mientras que las células de tumores benignos no lo hacen. Sin embargo, a más tardar con la elucidación de la estructura del ADN en los años 50 y el conocimiento de los cambios genéticos cancerígenos, la hipótesis de Warburg de las mitocondrias dañadas como elementos carcinógenos fue dejada de lado.
El efecto de Warburg, es decir, la fermentación del azúcar a pesar del oxígeno, que Warburg mismo describió como „glucólisis aeróbica“, sin embargo, ha sido confirmada en los últimos años por varios grupos de investigación[note]Langbein, S. et al. (2006): Expression of transketolase TKTL1 predicts colon and urothelial cancer patient survival: Warburg effect reinterpreted. Br J Cancer 94 (4): 578–585. [Link zum Artikel].[/note] [note]Schulz, T. J. et al. (2006): Induction of oxidative metabolism by mitochondrial frataxin inhibits cancer growth: Otto Warburg revisited. J Biol Chem 281 (2): 977–981. [Link zum Artikel].[/note] . Y también la suposición de Warburg, de que esto podía significar un importante punto de partida para la terapia del cáncer, resulta ser correcta en un número cada vez mayor de estudios. Del mismo modo, hoy en día se considera indiscutible que los tumores malignos consumen altos niveles de glucosa. Esta característica incluso ya se utiliza para el diagnóstico en la tomografía por emisión de positrones (PET). A este respecto, se inyecta al paciente una solución de glucosa radiomarcada débil, que se acumula en los tejidos fuertemente dependientes de glucosa y es visible durante la exploración. Por lo tanto, el radiólogo puede localizar posibles focos de cáncer.
→ El Factor de influencia de la dieta
Hoy se sabe que ciertos factores dietéticos como las nitrosaminas en las carnes curadas o toxinas de moho sobre los frutos secos rancios pueden causar daños cancerígenos en el ADN. Del mismo modo, los médicos están seguros en gran medida de que los ingredientes de alimentos específicos, tales como ciertas vitaminas, oligoelementos y fitoquímicos pueden contrarrestar la carcinogénesis. Sin embargo, también está cada vez más claro que además del componente genético el cáncer también presenta un fuerte componente metabólico. Así que no sólo las sustancias individuales que interactúan con el material genético, el ADN, desempeñan un papel. También la dieta en general, que en su totalidad ejerce una fuerte influencia sobre nuestro metabolismo, afecta así la génesis, el desarrollo y el tratamiento del cáncer. De este conocimiento se deriva el razonamiento de que a través de una alimentación cetogénica se pueden influenciar específicamente los procesos metabólicos, que son importantes para el crecimiento y la propagación de las células cancerosas.
La respiración celular: Obtención de energía con suficiente oxígeno
 En la mayoría de las células sanas del cuerpo, la producción de energía se efectúa en las las propias „centrales energéticas“ de la célula, es decir, las mitocondrias. El azúcar, las grasas y parcialmente también los aminoácidos (componentes de proteína) inicialmente se descomponen en productos intermedios, que luego se introducen en la mitocondria y se utilizan para formar el portador de energía ATP.
En la mayoría de las células sanas del cuerpo, la producción de energía se efectúa en las las propias „centrales energéticas“ de la célula, es decir, las mitocondrias. El azúcar, las grasas y parcialmente también los aminoácidos (componentes de proteína) inicialmente se descomponen en productos intermedios, que luego se introducen en la mitocondria y se utilizan para formar el portador de energía ATP.
Para esto, los azúcares tales como la glucosa se descomponen a través de un así llamado proceso de glucólisis para formar piruvato. Lo particular en la degradación del azúcar es que todavía fuera de las mitocondrias ya se producen 2 moléculas del portador de energía ATP.
El piruvato pasa a continuación a las mitocondrias donde se convierte en acetil-CoA. Acetil-CoA es un producto intermedio central en el metabolismo de la energía, que en la subsiguiente „respiración celular“ pasa por dos procesos metabólicos de etapas múltiples (ciclo de citrato y fosforilación oxidativa), que terminan en la formación del portador de energía ATP. Para este último paso se requiere oxígeno, que se oxida durante la respiración celular en dióxido de carbono (CO2) y agua (H2O).
Sin embargo, bajo ciertas circunstancias, este último paso no se desarrolla según lo previsto, por lo que en lugar de ello se forman radicales tales como el peróxido de hidrógeno (H2O2).
Glucólisis anaeróbica: Obtención de energía con carencia de oxígeno
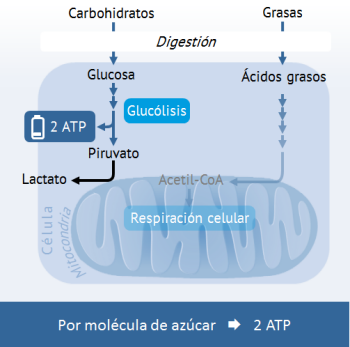 Con una falta temporal de oxígeno, el último paso de la producción de ATP en la mitocondria no puede implementarse. Esto ocurre, por ejemplo, en las células musculares sanas durante el esfuerzo físico intenso, cuando para la obtención de energía se consume más oxígeno del que se reabastece a través del torrente sanguíneo. Para continuar manteniendo en pie la producción de energía, las células utilizan el paso formador de ATP de la glucólisis. Debido a que el procesamiento adicional del piruvato en la mitocondria no es posible, éste en lugar de ello se transforma en ácido láctico.
Con una falta temporal de oxígeno, el último paso de la producción de ATP en la mitocondria no puede implementarse. Esto ocurre, por ejemplo, en las células musculares sanas durante el esfuerzo físico intenso, cuando para la obtención de energía se consume más oxígeno del que se reabastece a través del torrente sanguíneo. Para continuar manteniendo en pie la producción de energía, las células utilizan el paso formador de ATP de la glucólisis. Debido a que el procesamiento adicional del piruvato en la mitocondria no es posible, éste en lugar de ello se transforma en ácido láctico.
Dado que esta forma de producción de energía es extremadamente ineficiente (por molécula de azúcar sólo se obtienen 2 moléculas de ATP), las células vuelven a cambiar rápidamente a la respiración celular, en cuanto se disponga de oxígeno.
Glucólisis aeróbica: Producción de energía de células cancerosas agresivas
 Las células cancerosas en fermentación muestran un metabolismo de energía similar al de la glucólisis anaeróbica, incluso en presencia de oxígeno (es decir, también en condiciones aeróbicas). Dado que sólo 2 ATP se forman durante la degradación de los hidratos de carbono por unidad de glucosa, la célula cancerosa para cubrir su enorme demanda de energía depende de una alta ingesta de hidratos de carbono.
Las células cancerosas en fermentación muestran un metabolismo de energía similar al de la glucólisis anaeróbica, incluso en presencia de oxígeno (es decir, también en condiciones aeróbicas). Dado que sólo 2 ATP se forman durante la degradación de los hidratos de carbono por unidad de glucosa, la célula cancerosa para cubrir su enorme demanda de energía depende de una alta ingesta de hidratos de carbono.
Simultáneamente se producen enormes cantidades de ácido láctico, que se transporta al exterior para proteger a la célula cancerosa. Una parte del lactato (sal de ácido láctico) llega al hígado, donde se convierte en glucosa, que a su vez puede servir como fuente de energía para la célula cancerosa. Otra parte crea un entorno perjudicial ácido en torno al tejido tumoral, que por un lado destruye el tejido circundante y al mismo tiempo protege a las células cancerosas contra el ataque de las células inmunes.
Ventaja de supervivencia por fermentación de azúcar
El cambio a la fermentación de azúcar significa un bajo rendimiento de energía por unidad de glucosa, por lo que se requieren grandes cantidades de azúcar, hace que las células cancerosas dependan de una única fuente de energía y al mismo tiempo produce altas cantidades de ácido láctico que daña las células. ¿Por qué utilizan las células cancerosas esta forma aparentemente desfavorable de producción de energía a pesar de ello? La respuesta se encuentra en algunas importantes ventajas de supervivencia que trae consigo la glucólisis aeróbica:
- Suficiente obtención de energía en el interior del tumor pobre en oxígeno: Cuanto más grande es el tumor, peor es el suministro de oxígeno a las células tumorales en el interior del mismo. La glucosa, sin embargo, todavía puede penetrar fácilmente hasta el interior y ser aprovechada por estas células distantes de los vasos sanguíneos como fuente de energía.
- Suministro rápido de energía: El crecimiento de las células de cáncer requiere energía fácilmente disponible. Debido a la dependencia del oxígeno, sin embargo, el suministro de energía por la mitocondria es limitado y sólo ocurre en la medida en que se vuelve a suministrar oxígeno. La producción de energía a través de la fermentación de azúcar sólo depende de la disponibilidad de azúcar, pero debido a nuestra dieta rica en carbohidratos, esto no representa un factor limitante para la célula de cáncer.
- Protección contra la formación de radicales libres:Durante la producción de energía en la mitocondria, de vez en cuendo se forman como subproducto radicales reactivos de oxígeno (ROS) y, por lo tanto, estrés oxidativo que daña las células. La alta demanda de energía de la célula cancerosa aceleraría este proceso fuertemente y contribuiría rápidamente a su desaparición. La fermentación del azúcar permite la producción de energía sin la formación de radicales libres que dañan las células.
- Blindaje de protección de ácido láctico y degeneración de la matriz: Durante la fermentación del azúcar se producen grandes cantidades de ácido láctico, que se transportan al exterior para proteger a la célula. De esta manera, el tumor está rodeado por un entorno ácido que destruye el tejido circundante (degeneración de matriz) y permite la propagación invasiva de las células de cáncer. Al mismo tiempo, el blindaje de ácido láctico protege a las células cancerosas que se propagan contra el ataque de las células inmunes en el torrente sanguíneo.
- La resistencia al tratamiento: Mediante la „desconexión“ de las mitocondrias, las células cancerosas en fermentación se protegen además contra las terapias que están dirigidas contra una formación aumentada de radicales libres (irradiación) o que apuntan a la activación específica de la muerte celular, la apoptosis (quimioterapia) [note]Xu, R. H. et al. (2005): Inhibition of glycolysis in cancer cells: a novel strategy to overcome drug resistance associated with mitochondrial respiratory defect and hypoxia. Cancer Res 65 (2): 613–621. [Link zum Artikel].[/note] [note]Vaughn, A. E.; Deshmukh, M. (2008): Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nat Cell Biol 10 (12): 1477–1483. [Link zum Artikel].[/note].
El Factor de crecimiento insulina
Sin embargo azúcar desempeña un papel central en el desarrollo del cáncer, no sólo como fuente de energía preferente de las células de cáncer en fermentación. Los niveles elevados de azúcar en la sangre ya de por sí contribuyen al desarrollo de cáncer. Esto es atribuible a la hormona insulina, que es secretada después de cualquier comida rica en azúcar o almidón, a fin de disminuir los niveles de azúcar en la sangre nuevamente al valor normal. La insulina en sí, pero también el factor de crecimiento similar a la insulina IGF-1, actúan como promoteres del crecimiento, que en los ensayos con células han estimulado el crecimiento, la propagación y la metástasis de las células tumorales [note]Pollak, M. (2008): Insulin and insulin-like growth factor signalling in neoplasia. Nat Rev Cancer 8 (12): 915–928. [Link zum Artikel].[/note][note]Gallagher, E. J.; LeRoith, D. (2011): Minireview: IGF, Insulin, and Cancer. Endocrinology 152 (7): 2546–2551. [Link zum Artikel].[/note]. Esto es particularmente así cuando los niveles de insulina se incrementan de forma permanente en la sangre, como en el caso de una diabetes de tipo 2. Las personas con diabetes tienen un mayor riesgo de ciertos tipos de cáncer, como el de mama, útero, colon, estómago, hígado, vejiga y cáncer de páncreas [note]Hua, F.; Yu, J. J.; Hu, Z. W. (2016): Diabetes and cancer, common threads and missing links. Cancer Lett 374 (1): 54–61. [Link zum Artikel].[/note]. La probabilidad de que un diabético enferme, por ejemplo, de cáncer de mama o cáncer de colon, es aproximadamente un 23% a 26% más alto que para los no diabéticos [note]Bruijn, K. M. de et al. (2013): Systematic review and meta-analysis of the association between diabetes mellitus and incidence and mortality in breast and colorectal cancer. Br J Surg 100 (11): 1421–1429. [Link zum Artikel].[/note]. También independiente de la diabetes, diversos estudios han encontrado indicios de que una dieta alta en carbohidratos aumenta el riesgo de cáncer [note]Gnagnarella, P. et al. (2008): Glycemic index, glycemic load, and cancer risk: a meta-analysis. Am J Clin Nutr 87 (6): 1793–1801. [Link zum Artikel].[/note]. Ya para la prevención del cáncer, parece razonable mantener el consumo de carbohidratos moderado y evitar los picos de azúcar en la sangre, seguidos por una alta secreción de insulina. Pero también en el seguimiento seguirá desempeñando un papel importante una dieta baja en carbohidratos. De esta manera, los científicos han podido demostrar, entre otras cosas, que una dieta alta en carbohidratos aumenta la tasa de recaída en pacientes con cáncer, mientras que la posibilidad de supervivencia disminuye [note]Meyerhardt, J. A. et al. (2012): Dietary glycemic load and cancer recurrence and survival in patients with stage III colon cancer: findings from CALGB 89803. J Natl Cancer Inst 104 (22): 1702–1711. [Link zum Artikel].[/note]. Las mujeres cuyo cáncer de mama fue positivo para el receptor de IGF, aumentaron su tasa de reincidencia hasta en un 500% debido a una dieta de elevado índice glicémico, alta en carbohidratos [note]Emond, J. A. et al. (2014): Risk of breast cancer recurrence associated with carbohydrate intake and tissue expression of IGFI receptor. Cancer Epidemiol Biomarkers Prev 23 (7): 1273–1279. [Link zum Artikel].[/note].
Dieta cetogénica en lugar de ayuno
Informes aislados de casos de pacientes que ayunaron durante varios días antes de una quimioterapia o radiación, indican en repetidas ocasiones que existe una mejor tolerabilidad de la terapia y, por ejemplo, menos fatiga, náuseas, malestar gastrointestinal y dolor de cabeza [note]Safdie, F. M. et al. (2009): Fasting and cancer treatment in humans: A case series report. Aging (Albany NY) 1 (12): 988–1007. [Link zum Artikel].[/note]. En base a los ensayos en ratones y en células sabemos que los niveles bajos de azúcar en sangre y los niveles más bajos de IGF-1 desempeñan un papel importante en esto [note]Raffaghello, Lizzia et al. (2010): Fasting and differential chemotherapy protection in patients. Cell Cycle 9 (22): 4474–4476. [Link zum Artikel].[/note].
Sin embargo, el ayuno no es apropiado para todos los pacientes con cáncer e implica el riesgo de perder más sustancia corporal vital. Una dieta cetogénica es capaz de reducir el azúcar en la sangre, así como los niveles de IGF-1, para adaptar las células sanas a un metabolismo de ayuno y aún así proporcionar al cuerpo la energía, proteínas y micronutrientes que necesita.
¿Qué evidencia de efectividad hay hasta ahora?
Muchos críticos de los conceptos de la dieta cetogénica se quejan de que hay pocos estudios sobre la eficacia en seres humanos. De hecho, muchos descubrimientos sobre los efectos de la privación del azúcar o la inhibición del metabolismo de fermentación en el crecimiento del cáncer y la sensibilidad terapéutica se han obtenido en experimentos animales y citológicos (algunos de estos estudios, los hemos resumido para usted: Bibliografía).
Un problema fundamental de los estudios en humanos es, sin embargo: que los mismos cuestan una enorme cantidad de dinero. ¿Pero qué gran empresa estaría interesada en invertir dinero para la investigación de un concepto nutricional que teóricamente también es factible con alimentos simples? Lamentablemente, ninguna, de tal manera que hasta el momento sólo podemos basarnos en los numerosos informes de casos positivos obtenidos en la práctica y los resultados de clínicas que emplean el ayuno o la alimentación cetogénica en sus pacientes. Pero la tendencia actual está demostrando que debido al número creciente de hallazgos prometedores en experimentos citológicos y animales, cada vez más grupos de investigación y hospitales están dispuestos a realizar sus propios ensayos a pequeña escala en humanos.
Primeros estudios de seguridad y eficacia en pacientes:
- Hospital de Schweinfurt: Seis pacientes se alimentaron independientemente de manera cetogénica mientras se sometieron a irradiación. Cuatro de los mismos alcanzaron un nivel suficiente de cuerpos cetónicos en el suero. Todos los pacientes perdieron peso, pero sólo en grasa y no en la masa muscular. La constitución general durante la irradiación fue muy positiva y todos se sentían bien con la dieta. Cinco de los pacientes alcanzaron, como se esperaba, una regresión de los tumores. Sólo un paciente con cáncer de pulmón de células pequeñas metastásico mostró una leve progresión de la enfermedad, que, sin embargo, progresó más rápidamente cuando se suspendió la dieta [note]Klement, Rainer J.; Sweeney, Reinhart A. (2016): Impact of a ketogenic diet intervention during radiotherapy on body composition: I. Initial clinical experience with six prospectively studied patients. BMC Research Notes 9 (1): 143. [Link zum Artikel].[/note].
- Estudio ERGO: El estudio realizado por la Universidad de Tubinga examinó el efecto de una dieta cetogénica en 20 pacientes con glioblastoma repetido (una forma de tumor cerebral incurable y difícil de tratar). Durante el tratamiento no hubo efectos secundarios graves. Como resultado, la dieta cetogénica se ha estimado como factible y segura, pero que sólo es útil como una opción de terapia de apoyo [note]Rieger, Johannes et al. (2014): ERGO: a pilot study of ketogenic diet in recurrent glioblastoma. Int J Oncol 44 (6): 1843–1852. [Link zum Artikel].[/note].
- Hospital de la Universidad de Würzburg: El Hospital de la Universidad de Würzburg ofrece a los pacientes la posibilidad de someterse a una dieta rica en aceites y proteínas, además de la terapia estándar. Los pacientes que se sometieron al periodo de tratamiento de 3 meses con la dieta cetogénica mostraron algunas mejoras en su calidad de vida y en algunos parámetros de la sangre [note]Schmidt, M. et al. (2011): Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: A pilot trial. Nutr Metab (Lond) 8: 54. [Link zum Artikel].[/note].
- Universidad de Pittsburgh, EE.UU.: Los investigadores analizaron los datos de 53 pacientes con glioblastoma, seis de los cuales se sometieron a una dieta cetogénica durante el tratamiento. La dieta fue bien tolerada y los efectos secundarios de la terapia fueron relativamente escasos. En comparación con los otros pacientes, los niveles de glucosa en la sangre de los pacientes tratados con la dieta cetogénica se encontraban en el rango normal, a pesar del tratamiento con esteroides [note]Champ, C. E. et al. (2014): Targeting metabolism with a ketogenic diet during the treatment of glioblastoma multiforme. J Neurooncol 117 (1): 125–131. [Link zum Abstract].[/note].
- Universidad de Leiden, Países Bajos: Trece pacientes con cáncer de mama HER2-negativo fueron examinadas, de las cuales 7 ayunaron durante un día antes y después de la quimioterapia. Para ellas, en comparación con las mujeres que no ayunaron, la quimioterapia tuvo un menor efecto sobre los valores de la sangre. En particular, los valores de eritrocitos y plaquetas fueron significativamente mejores [note]Groot, Stefanie de et al. (2015): The effects of short-term fasting on tolerance to (neo) adjuvant chemotherapy in HER2-negative breast cancer patients: a randomized pilot study. BMC Cancer 15: 652. [Link zum Artikel].[/note].
¿Por qué vale la pena la prueba?
Aun sin tomar en cuenta el efecto anticanceroso directo, una dieta baja en carbohidratos conlleva para el paciente una serie de ventajas:
- Suficiente energía por un alto contenido de grasa,
- Suministro de importantes nutrientes proteicos para la conservación de la sustancia corporal, el sistema inmune y la actividad metabólica,
- Suministro de importantes vitaminas y minerales, así como de ingredientes vegetales bioactivos a través de verduras bajas en carbohidratos, bayas, nueces, hierbas y especias,
- Aporte de ácidos grasos esenciales antiinflamatorios a través de aceites vegetales de alta calidad, nueces y pescados grasos de agua fría,
- La reducción de los factores de riesgo relacionados con el cáncer mediante la reducción de los niveles de azúcar en sangre y de insulina, así como la reducción de la obesidad o la masa de grasa inflamatoria.
Puesto que el cuerpo está adaptado evolutivamente para ser capaz de vivir con una baja ingesta de hidratos de carbono, los efectos secundarios a largo plazo de la reducción de hidratos de carbono son poco probables.
Y no menos importante es la opción de poder apoyar su propia terapia utilizando una alimentación adaptada a las particularidades del metabolismo del tumor, lo que a muchos pacientes con cáncer les da la sensación de poder contribuir de forma activa a su recuperación. Esto tiene un tremendo efecto psicológico que no se debe subestimar en la terapia.
Directorio de origen

